1. Abernethy, PJ, Jürimäe, J, Logan, PA, Taylor, AW, and Thayer, RE. Acute and chronic response of skeletal muscle to resistance exercise. Sports Med 17: 22-38, 1994.
2. Ahtiainen, JP, Pakarinen, A, Alen, M, Kraemer, WJ, and Häkkinen, K. Muscle hypertrophy, hormonal adaptations and strength development during strength training in strength-trained and untrained men. Eur J Appl Physiol 89: 555-563, 2003.
3. Alén, M, Pakarinen, A, Häkkinen, K, and Komi, PV. Responses of serum androgenic-anabolic and catabolic hormones to prolonged strength training. Int J Sport Med 9: 229-233, 1988.
4. Allen, DG, Whitehead, NP, and Yeung, EW. Mechanisms of stretch-induced muscle damage in normal and dystrophic muscle: Role of ionic changes. J Physiol 567: 723-735, 2005.
5. Anderson, KG and Behm, DG. Maintenance of EMG activity and loss of force output with instability. J Strength Cond Res 18: 637-640, 2004.
6. Anderson, KG and Behm, DG. Trunk muscle activity increases with unstable squat movements. Can J Appl Physiol 30: 33-45, 2005.
7. Antonio, J. Nonuniform response of skeletal muscle to heavy resistance training: can bodybuilders induce regional muscle hypertrophy? J Strength Cond Res 14: 102-113, 2000.
8. Antonio, J and Gonyea WJ. Role of muscle fiber hypertrophy and hyperplasia in intermittently stretched avian muscle. J Appl Physiol 4: 1893-1898, 1993.
9 Aronson, D, Boppart, MD, Dufresne, SD, Fielding, RA, and Goodyear, LJ. Exercise stimulates c-Jun NH2 kinase activity and c-Jun transcriptional activity in human skeletal muscle. Biochem Biophys Res Comm 251: 106-110, 1998.
10. Aronson, D, Dufresne, SD, and Goodyear, LJ. Contractile activity stimulates the c-Jun NH2-terminal kinase pathway in rat skeletal muscle. J Biol Chem 272: 25636-25640, 1997.
11. Baar, K and Esser, KA. Phosphorylation of p70. S6k correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol 276: C120-C127, 1999.
12. Ballor, DL, Becque, MD, and Katch, VL. Metabolic responses during hydraulic resistance exercise. Med Sci Sports Exerc 19: 363-367, 1987.
13. Bamman, MM, Shipp, JR, Jiang, J, Gower, BA, Hunter, GR, Goodman, A, McLafferty, CL Jr, Urban, RJ. Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans. Am J Physiol Endocrinol Metab 280: E383-E390, 2001.
14. Barnett, C, Kippers, V, and Turner, P. Effects of variations of the bench press exercise on the EMG activity of five shoulder muscles. J Strength Cond Res 9: 222-227, 1995.
15. Barton-Davis, ER, Shoturma, DI, and Sweeney, HL. Contribution of satellite cells to IGF-I induced hypertrophy of skeletal muscle. Acta Physiol Scan 167: 301-305, 1999.
16. Bickel, CS, Slade, J, Mahoney, E, Haddad, F, Dudley, GA, and Adams, GR. Time course of molecular responses of human skeletal muscle to acute bouts of resistance exercise. J Appl Physiol 98: 482-488, 2005.
17. Bloomer, RJ and Ives, JC. Varying neural and hypertrophic influences in a strength program. Strength Cond J 22: 30, 2000.
18. Bodine, SC, Stitt, TN, Gonzalez, M, Kline, WO, Stover, GL, Bauerlein, R, Zlotchenko, E, Scrimgeour, A, Lawrence, JC, Glass, DJ, and Yancopoulos, GD. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat Cell Biol 3: 1014-1019, 2001.
19. Brahm, H, Pehl-Aulin, K, Saltin, B, and Ljunghall, S. Net fluxes over working thigh of hormones, growth factors and biomarkers of bone metabolism during short lasting dynamic exercise. Calc Tiss Int 60: 175-180, 1997.
20. Bricout, VA, Germain, PS, Serrurier, BD, and Guezennec, CY. Changes in testosterone muscle receptors: Effects of an androgen treatment on physically trained rats. Cell Mol Biol 40: 291-294, 1994.
21. Brown, JMM, Solomon, C, and Paton, M. Further evidence of functional differentiation within biceps brachii. Electromyogr Clin Neurophysiol 33: 301-309, 1993.
22. Buresh, R, Berg, K, and French, J. The effect of resistive exercise rest interval on hormonal response, strength, and hypertrophy with training. J Strength Cond Res 23: 62-71, 2009.
23. Burridge, K and Chrzanowska-Wodnicka, M. Focal adhesions, contractility, and signaling. Ann Rev Cell Dev Biol 12: 463-519, 1996.
24. Campos, GE, Luecke, TJ, Wendeln, HK, Toma, K, Hagerman, FC, Murray, TF, Ragg, KE, Ratamess, NA, Kraemer, WJ, and Staron, RS. Muscular adaptations in response to three different resistance-training regimens: Specificity of repetition maximum training zones. Eur J Appl Physiol 88: 50-60, 2002.
25. Chan, ST, Johnson, AW, Moore, MH, Kapadia, CR, and Dudley, HA. Early weight gain and glycogen-obligated water during nutritional rehabilitation. Hum Nutr Clin Nutr 36: 223-232, 1982.
26. Chin, ER. Role of Ca2+/calmodulin-dependent kinases in skeletal muscle plasticity. J Appl Physiol 99: 414-423, 2005.
27. Cornelison, DD and Wold, BJ. Single-cell analysis of regulatory gene expression in quiescent and activated mouse skeletal muscle satellite cells. Adv Dev Biol 15; 191: 270-283, 1997.
28. Cote, C, Simoneau, JA, Lagasse, P, Boulay, M, Thibault, MC, Marcotte, M, and Bouchard, B. Isokinetic strength training protocols: Do they produce skeletal muscle hypertrophy? Arch Phys Med Rehab 69: 282-285, 1988.
29. Craig, B and Kang, H. Growth hormone release following single versus multiple sets of back squats: Total work versus power. J Strength Cond Res 8: 270-275, 1994.
30. Crameri, RM, Langberg, H, Magnusson, P, Jensen, CH, Schrøder, HD, Olesen, JL, Suetta, C, Teisner, B, and Kjaer, M. Changes in satellite cells in human skeletal muscle after a single bout of high intensity exercise. J Physiol 558: 333-340, 2004.
31. Crewther, B, Keogh, J, Cronin, J, and Cook, C. Possible stimuli for strength and power adaptation: Acute hormonal responses. Sport Med 36: 215-238, 2006.
32. de Salles, BF, Simão, R, Miranda, F, Novaes Jda, S, Lemos, A, and Willardson, JM. Rest interval between sets in strength training. Sport Med 39: 765-777, 2009.
33. Deschenes, MR, Kraemer, WJ, Maresh, CM, and Crivello, JF. Exercise induced hormonal changes and their effects upon skeletal muscle muscle tissue. Sport Med 12: 80-89, 1991.
34. DeVol, DL, Rotwein, P, Sadow, JL, Novakofski, J, and Bechtel, PJ. Activation of insulin-like growth factor gene expression during work-induced skeletal muscle growth. Am J Physiol 259: E89-E95, 1990.
35. Dunn, SE, Burns, JL, and Michel, RN. Calcineurin is required for skeletal muscle hypertrophy. J Biol Chem 274: 21908-21912, 1999.
36. Dunn, SE, Chin, ER, and Michel, RN. Matching of calcineurin activity to upstream effectors is critical for skeletal muscle fiber growth. J Cell Biol 151, 663-672, 2000.
37. Essén-Gustavsson, B and Tesch, PA. Glycogen and triglyceride utilization in relation to muscle metabolic characteristics in men performing heavy-resistance exercise. Eur J Appl Physiol Occupl Physiol 61: 5-10, 1990.
38. Evans, WJ. Effects of exercise on senescent muscle. Clin Orthopaed Rel Res 403(Suppl.): S211-S220, 2002.
39. Farthing, JP and Chilibeck, PD. The effects of eccentric and concentric training at different velocities on muscle hypertrophy. Eur J Appl Physiol 89: 578-586, 2003.
40. Folland, JP, Irish, CS, Roberts, JC, Tarr, JE, and Jones, DA. Fatigue is not a necessary stimulus for strength gains during resistance training. Br J Sports Med 36: 370-373, 2002.
41. Frigeri, A, Nicchia, GP, Verbavatz, JM, Valenti, G, and Svelto, M. Expression of aquaporin-4 in fast-twitch fibers of mammalian skeletal muscle. J Clin Invest 102: 695-703, 1998.
42. Fry, AC. The role of resistance exercise intensity on muscle fibre adaptations. Sport Med 34: 663-679, 2004.
43. Fry, AC and Kraemer, WJ. Resistance exercise overtraining and overreaching: Neuroendocrine responses. Sport Med 23: 106-129, 1997.
44. Fry, AC, Kraemer, WJ, Stone, MH, Warren, BJ, Fleck, SJ, Kearney, JT, and Gordon, SE. Endocrine responses to overreaching before and after 1 year of weightlifting. Can J Appl Physiol 19: 400-410, 1994.
45. Garg, C. Effects of isotonic (dynamic constant external resistance) eccentric strength training at various speeds on concentric and isometric strength of quadriceps muscle. Ind J Physiother Occup Ther 3: 2009.
46. Glass, SC and Armstrong, T. Electromyographical activity of the pectoralis muscle during incline and decline bench presses. J Strength Cond Res 11: 163-167, 1997.
47. Goldberg, AL, Etlinger, JD, Goldspink, DF, and Jablecki, C. Mechanism of work-induced hypertrophy of skeletal muscle. Med Sci Sport Exerc 7: 185-198, 1975.
48. Goldspink, G. Gene expression in skeletal muscle. Biochem Soc Trans 30: 285-290, 2002.
49. Goldspink, G. Mechanical signals, IGF-I gene splicing, and muscle adaptation. Physiology (Bethesda), 20: 232-238, 2005.
50. Gordon, SE, Kraemer, WJ, Vos, NH, Lynch, JM, and Knuttgen, HG. Effect of acid-base balance on the growth hormone response to acute high-intensity cycle exercise. J Appl Physiol 76: 821-829, 1994.
51. Goto, K, Ishii, N, Kizuka, T, and Takamatsu, K. The impact of metabolic stress on hormonal responses and muscular adaptations. Med Sci Sport Exerc 37: 955-963, 2005.
52. Goto, K, Nagasawa, M, Yanagisawa, O, Kizuka, T, Ishii, N, and Takamatsu, K. Muscular adaptations to combinations of high- and low-intensity resistance exercises. J Strength Cond Res 18: 730-737, 2004.
53. Grant, AC, Gow, IF, Zammit, VA, Shennan, DB. Regulation of protein synthesis in lactating rat mammary tissue by cell volume. Biochim Biophysic Acta 1475: 39-46, 2000.
54. Haddad, F and Adams, GR. Selected contribution: acute cellular and molecular responses to resistance exercise. J Appl Physiol 93: 394-403, 2002.
55. Häggmark, T and Thorstensson, A. Fibre types in human abdominal muscles. Acta Physiolog Scan 107: 319-325, 1979.
56. Häkkinen, K, Komi, PV, and Alén, M. Effect of explosive type strength training on isometric force- and relaxation-time, electromyographic and muscle fibre characteristics of leg extensor muscles. Acta Physiolog Scan 125: 587-600, 1985.
57. Häkkinen, K and Pakarinen, A. Acute hormonal responses to two different fatiguing heavy-resistance protocols in male athletes. J Appl Physiol 74: 882-887, 1993.
58. Häkkinen, K and Pakarinen, A. Serum hormones in male strength athletes during intensive short term strength training. Eur J Appl Physiol 63: 191-199, 1991.
59. Häkkinen, KA, Pakarinen, A, Alen, M, Kauhanen, H, and Komi, PV. Relationships between training volume, physical performance capacity, and serum hormone concentrations during prolonged training in elite weight lifters. Int J Sport Med 8(Suppl.): 61-65, 1987.
60. Häkkinen, K, Pakarinen, A, Alen, M, Kauhanen, H, and Komi, PV. Neuromuscular and hormonal adaptations in athletes to strength training in two years. J Appl Physiol 65: 2406-2412, 1988.
61. Häkkinen, K, Pakarinen, A, Kraemer, WJ, Newton, RU, and Alen, M. Basal concentrations and acute responses of serum hormones and strength development during heavy resistance training in middle-aged and elderly men and women. J Gerontol. Ser A, Biol Sci Med Sci 55: B95-B105, 2000.
62. Halson, SL and Jeukendrup, AE. Does overtraining exist? An analysis of overreaching and overtraining research. Sport Med 34: 967-981, 2004.
63. Hameed, M, Lange, KH, Andersen, JL, Schjerling, P, Kjaer, M, Harridge, SD, and Goldspink, G. The effect of recombinant human growth hormone and resistance training on IGF-I mRNA expression in the muscles of elderly men. J Physiol 555: 231-240, 2004.
64. Hansen, S, Kvorning, T, Kjaer, M, and Sjøgaard, G. The effect of short-term strength training on human skeletal muscle: The importance of physiologically elevated hormone levels. Scan J Med Sci Sport 11: 347-354, 2001.
65. Häussinger, D. The role of cellular hydration in the regulation of cell function. Biochem J 313: 697-710, 1996.
66. Hawke, TJ and Garry, DJ. Myogenic satellite cells: Physiology to molecular biology. J Appl Physiol 91: 534-551, 2001.
67. Heron, MI and Richmond, FJR. In-series fiber architecture in long human muscles. J Morphol 216: 35-45, 1993.
68. Higbie, EJ, Cureton, KJ, Warren, GL III, and Prior, BM. Effects of concentric and eccentric training on muscle strength, cross-sectional area, and neural activation. J Appl Physiol 81: 2173-2181, 1996.
69. Hill, M and Goldspink, G. Expression and splicing of the insulin-like growth factor gene in rodent muscle is associated with muscle satellite (stem) cell activation following local tissue damage. J Physiol 549: 409-418, 2003.
70. Hoffman, JR, Im, J, Rundell, KW, Kang, J, Nioka, S, Spiering, BA, Kime, R, and Chance, B. Effect of muscle oxygenation during resistance exercise on anabolic hormone response. Med Sci Sport Exerc 35: 1929-1934, 2003.
71. Holm, L, Reitelseder, S, Pedersen, TG, Doessing, S, Petersen, SG, Flyvbjerg, A, Andersen, JL, Aagaard, P, and Kjaer, M. Changes in muscle size and MHC composition in response to resistance exercise with heavy and light loading intensity. J Appl Physiol 105: 1454-1461, 2008.
72. Hornberger, TA and Chien, S. Mechanical stimuli and nutrients regulate rapamycin-sensitive signaling through distinct mechanisms in skeletal muscle. J Cell Biochem 97: 1207-1216, 2006.
73. Hornberger, TA, Chu, WK, Mak, YW, Hsiung, JW, Huang, SA, and Chien, S. The role of phospholipase D and phosphatidic acid in the mechanical activation of mTOR signaling in skeletal muscle. Proc Natl Acad Sci USA 103: 4741-4746, 2006.
74. Hortobágyi, T, Barrier, J, Beard, D, Braspennincx, J, and Koens, J. Greater initial adaptations to submaximal muscle lengthening than maximal shortening. J Appl Physiol 81: 1677-1682, 1996.
75. Iida, K, Itoh, E, Kim, DS, del Rincon, JP, Coschigano, KT, Kopchick, JJ, and Thorner, MO. Muscle mechano growth factor is preferentially induced by growth hormone in growth hormone-deficient lit/lit mice. J Physiol 15; 560: 341-349, 2004.
76. Izquierdo, M, Ibañez, J, González-Badillo, JJ, Häkkinen, K, Ratamess, NA, Kraemer, WJ, French, DN, Eslava, J, Altadill, A, Asiain, X, and Gorostiaga, EM. Differential effects of strength training leading to failure versus not to failure on hormonal responses, strength and muscle power increases. J Appl Physiol 100: 1647-1656, 2006.
77. Jacinto, E and Hall, MN. Tor signalling in bugs, brain and brawn. Nat Rev Mol Cell Biol 4: 117-126, 2003.
78. Jensky, NE, Sims, JK, Dieli-Conwright, CM, Sattler, FR, Rice, JC, and Schroeder, ET. Exercise does not influence myostatin and follistatin messenger RNA expression in young women. J Strength Cond Res 24: 522-530, 2010.
79. Jones, DA and Rutherford, OM. Human muscle strength training: The effects of three different regimens and the nature of the resultant changes. J Physiol 391: 1-11, 1987.
80. Kadi, F, Bonnerud, P, Eriksson, A, and Thornell, LE. The expression of androgen receptors in human neck and limb muscles: Effects of training and self-administration of androgenic-anabolic steroids. Histochem Cell Biol 113: 25-29, 2000.
81. Kawada, S and Ishii, N. Skeletal muscle hypertrophy after chronic restriction of venous blood flow in rats. Med Sci Sport Exerc 37: 1144-1150, 2005.
82. Keeler, LK, Finkelstein, LH, Miller, W, and Fernhall, B. Early-phase adaptations of traditional-speed vs. SuperSlow resistance training on strength and aerobic capacity in sedentary individuals. J Strength Cond Res 15: 309-314, 2001.
83. Kefaloyianni, E, Gaitanaki, C, and Beis, I. ERK1/2 and p38-MAPK signalling pathways, through MSK1, are involved in NF-kappaB transactivation during oxidative stress in skeletal myoblasts. Cell Signal 18: 2238-2251, 2006.
84. Kelley, G. Mechanical overload and skeletal muscle fiber hyperplasia: A meta-analysis. J Appl Physiol 81: 1584-1588, 1996.
85. Kerksick, CM, Rasmussen, CJ, Lancaster, SL, Magu, B, Smith, P, Melton, C, Greenwood, M, Almada, AL, Earnest, CP, and Kreider, RB. The effects of protein and amino acid supplementation on performance and training adaptations during ten weeks of resistance training. J Strength Cond Res 20: 643-653, 2006.
86. Kerksick, CM, Wilborn, CD, Campbell, BI, Roberts, MD, Rasmussen, CJ, Greenwood, M, and Kreider, RB. Early-phase adaptations to a split-body, linear periodization resistance training program in college-aged and middle-aged men. J Strength Cond Res 23: 962-971, 2009.
87. Kimball, SR, Farrell, PA, and Jefferson, LS. Invited review: Role of insulin in translational control of protein synthesis in skeletal muscle by amino acids or exercise. J Appl Physiol 93: 1168-1180, 2002.
88. Kramer, HF and Goodyear, LJ. Exercise, MAPK, and NF-kappaB signaling in skeletal muscle. J Appl Physiol 103: 388-395, 2007.
89. Kraemer, WJ, Adams, K, Cafarelli, E, Dudley, GA, Dooly, C, Feigenbaum, MS, Fleck, SJ, Franklin, B, Fry, AC, Hoffman, JR, Newton, RU, Potteiger, J, Stone, MH, Ratamess, NA, Triplett-McBride, T, and American College of Sports Medicine. American College of Sports Medicine position stand. Progression models in resistance training for healthy adults. Med Sci Sport Exerc 34: 364-380, 2002.
90. Kraemer, WJ, Fleck, SJ, Dziados, JE, Harman, EA, Marchitelli, LJ, Gordon, SE, Mello, R, Frykman, PN, Koziris, LP, and Triplett, NT. Changes in hormonal concentrations after different heavy-resistance exercise protocols in women. J Appl Physiol 75: 594-604, 1993.
91. Kraemer, WJ, Fry, AC, Warren, BJ, Stone, MH, Fleck, SJ, Kearney, JT, Conroy, BP, Maresh, CM, Weseman, CA, Triplett, NT, et al. Acute hormonal responses in elite junior weightlifters. Int J Sport Med 13: 103-109, 1992.
92. Kraemer, WJ, Gordon, SE, Fleck, SJ, Marchitelli, LJ, Mello, R, Dziados, JE, Friedl, K, Harman, E, Maresh, C, and Fry, AC. Endogenous anabolic hormonal and growth factor responses to heavy resistance exercise in males and females. Int J Sport Med 12: 228-235, 1991.
93. Kraemer, WJ, Häkkinen, K, Newton, RU, Nindl, BC, Volek, JS, McCormick, M, Gotshalk, LA, Gordon, SE, Fleck, SJ, Campbell, WW, Putukian, M, and Evans, WJ. Effects of heavy-resistance training on hormonal response patterns in younger vs. older men. J Appl Physiol 87: 982-992, 1999.
94. Kraemer, WJ, Marchitelli, L, Gordon, SE, Harman, E, Dziados, JE, Mello, R, Frykman, P, McCurry, D, and Fleck, SJ. Hormonal and growth factor responses to heavy resistance exercise protocols. J Appl Physiol 69: 1442-1450, 1990.
95. Kraemer, WJ, Noble, BJ, Clark, MJ, and Culver, BW. Physiologic responses to heavy-resistance exercise with very short rest periods. Int J Sport Med 8: 247-252, 1987.
96. Kraemer, WJ and Ratamess, NA. Hormonal responses and adaptations to resistance exercise and training. Sport Med 35: 339-361, 2005.
97. Krieger, JW. Single vs. multiple sets of resistance exercise for muscle hypertrophy: A meta-analysis. J Strength Cond Res 24: 1150-1159, 2010.
98. Kubota, A, Sakuraba, K, Sawaki, K, Sumide, T, and Tamura, Y. Prevention of disuse muscular weakness by restriction of blood flow. Med Sci Sport Exerc 40: 529-534, 2008.
99. Kuipers, H and Keizer, HA. Overtraining in elite athletes. Review and directions for the future. Sports Medicine 6, 79-92.
100. Kvorning, T, Andersen, M, Brixen, K, and Madsen, K. Suppression of endogenous testosterone production attenuates the response to strength training: A randomized, placebo-controlled, and blinded intervention study. Am J Physiol: Endocrinol Metab 291: E1325-E1332, 2006.
101. Lange, KH, Andersen, JL, Beyer, N, Isaksson, F, Larsson, B, Rasmussen, MH, Juul, A, Bülow, J, and Kjaer, M. GH administration changes myosin heavy chain isoforms in skeletal muscle but does not augment muscle strength or hypertrophy, either alone or combined with resistance exercise training in healthy elderly men. J Clin Endocrinol Metab 87: 513-523, 2002.
102. Lexell, J, Henriksson-Larsén, K, and Sjöström, M. Distribution of different fibre types in human skeletal muscles. 2. A study of cross-sections of whole m. vastus lateralis. Acta Physiolog Scan 117: 115-122, 1983.
103. Lindman, R, Eriksson, A, and Thornell, LE. Fiber type composition of the human female trapezius muscle: Enzyme-histochemical characteristics. Am J Anat 190: 385-392, 1991.
104. Linnamo, V, Pakarinen, A, Komi, PV, Kraemer, WJ, and Häkkinen, K. Acute hormonal responses to submaximal and maximal high intensity resistance and explosive exercise in men and women. J Strength Cond Res 19, 566-571, 2005.
105. Loebel, CC and Kraemer, WJ. A brief review: Testosterone and resistance exercise in men. J Strength Cond Res 12: 57-63, 1998.
106. Low, SY, Rennie, MJ, and Taylor, PM. Signaling elements involved in amino acid transport responses to altered muscle cell volume. FASEB J 11: 1111-1117, 1997.
107. Lynn, R and Morgan, DL. Decline running produces more sarcomeres in rat vastus intermedius muscle fibers than does incline running. J Appl Physiol 77: 1439-1444, 1994.
108. MacDougall, JD, Sale, DG, Alway, SE, and Sutton, JR. Muscle fiber number in biceps brachii in bodybuilders and control subjects. J Appl Physiol 57: 1399-1403, 1984.
109. MacDougall, JD, Sale, DG, Elder, GC, Sutton, JR. Muscle ultrastructural characteristics of elite powerlifters and bodybuilders. Eur J Appl Physiol Occup Physiol 48: 117-126, 1982.
110. Marshall, PWM and Murphy, BA. Increased deltoid and abdominal muscle activity during swiss ball bench press. J Strength Cond Res 20: 745-750, 2006.
111. Maughan, RJ, Watson, JS, and Weir, J. Strength and cross-sectional area of human skeletal muscle. J Physiol 338: 37-49, 1983.
112. McBride JM, Cormie, P, and Deane, R. Isometric squat force output and muscle activity in stable and unstable conditions. J Strength Cond Res 20: 915-918, 2006.
113. McCall, GE, Byrnes, WC, Fleck, SJ, Dickinson, A, and Kraemer, WJ. Acute and chronic hormonal responses to resistance training designed to promote muscle hypertrophy. Can J Appl Physiol 24: 96-107, 1999.
114. McCaulley, GO, McBride, JM, Cormie, P, Hudson, MB, Nuzzo, JL, Quindry, JC, and Travis Triplett, N. Acute hormonal and neuromuscular responses to hypertrophy, strength and power type resistance exercise. Eur J Appl Physiol 105: 695-704, 2009.
115. McDonagh, MJN and Davies, CTM. Adaptive response of mammalian skeletal muscle to exercise with high loads. Eur J Appl Physiol 52: 139-155, 1984.
116. McHugh, MP, Connolly, DA, Eston, RG, and Gleim, GW. Electromyographic analysis of exercise resulting in symptoms of muscle damage. J Sport Sci 18: 163-172, 2000.
117. McKay, BR, O'Reilly, CE, Phillips, SM, Tarnopolsky, MA, and Parise, G. Co-expression of IGF-1 family members with myogenic regulatory factors following acute damaging muscle-lengthening contractions in humans. J Physiol 15: 5549-5560, 2008.
118. Michel, RN, Dunn, SE, and Chin, ER. Calcineurin and skeletal muscle growth. Proc Nutr Soc 63: 341-349, 2004.
119. Michels, G and Hoppe, UC. Rapid actions of androgens. Fron Neuroendocrin 29: 182-198, 2008.
120. Millar, ID, Barber, MC, Lomax, MA, Travers, MT, and Shennan, DB. Mammary protein synthesis is acutely regulated by the cellular hydration state. Biochem Biophys Res Comm 230: 351-355, 1997.
121. Miranda, H, Fleck, SJ, Simão, R, Barreto, AC, Dantas, EH, and Novaes, J. Effect of two different rest period lengths on the number of repetitions performed during resistance training. J Strength Cond Res 21: 1032-1036, 2007.
122. Moore, DR, Phillips, SM, Babraj, JA, Smith, K, and Rennie, MJ. Myofibrillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening contractions. Am J Physiol Endocrinol Metab 288: E1153-E1159, 2005.
123. Moss, FP and Leblond, CP. Satellite cells are the source of nuclei in muscles of growing rats. Anat Rec 170: 421-435, 1970
124. Mulligan, SE, Fleck, SJ, Gordon, SE, and Koziris, LP. Influence of resistance exercise volume on serum growth hormone and cortisol concentrations in women. J Strength Cond Res 10: 256-262, 1996.
125. Musarò, A, McCullagh, KJ, Naya, FJ, Olson, EN, and Rosenthal, N. IGF-1 induces skeletal myocyte hypertrophy through calcineurin in association with GATA-2 and NF-ATc1. Nature 400: 581-585, 1999.
126. Nader, GA. Molecular determinants of skeletal muscle mass: Getting the “AKT” together. Int J Biochem Cell Biol 37: 1985-1996, 2005.
127. Nardone, A, Romanò, C, and Schieppati, M. Selective recruitment of high-threshold human motor units during voluntary isotonic lengthening of active muscles. J Physiol 409: 451-471, 1989.
128. Nardone, A and Schieppati, M. Shift of activity from slow to fast muscle during voluntary lengthening contractions of the triceps surae muscles in humans. J Physiol 395: 363-381, 1988.
129. Neils, CM, Udermann, BE, Brice, GA, Winchester, JB, and McGuigan, MR. Influence of contraction velocity in untrained individuals over the initial early phase of resistance training. J Strength Cond Res 19: 883-887, 2005.
130. Nindl, BC, Kraemer, WJ, Gotshalk, LA, Marx, JO, Volek, JS, Bush, FA, Häkkinen, K, Newton, RU, and Fleck, SJ. Testosterone responses after resistance exercise in women: Influence of regional fat distribution. Int J Sport Nutr Exerc Metab 11: 451-465, 2001.
131. Nindl, BC, Kraemer, WJ, Marx, JO, Tuckow, AP, and Hymer, WC. Growth hormone molecular heterogeneity and exercise. Exerc Sport Sci Rev 31: 161-166, 2003.
132. Nisell, R and Ekholm, J. Joint load during the parallel squat in powerlifting and force analysis of in vivo bilateral quadriceps tendon rupture. Scan J Sport Sci 8: 63-70, 1986.
133. Nogueira, W, Gentil, P, Mello, SN, Oliveira, RJ, Bezerra, AJ, and Bottaro, M. Effects of power training on muscle thickness of older men. Int J Sport Med 30: 200-204, 2009.
134. Ojasto, T and Häkkinen, K. Effects of different accentuated eccentric loads on acute neuromuscular, growth hormone, and blood lactate responses during a hypertrophic protocol. J Strength Cond Res 23: 946-953, 2009.
135. Paul, AC and Rosenthal, N. Different modes of hypertrophy in skeletal muscle fibers. J Cell Biol 18: 156: 751-760, 2002.
136. Pierce, JR, Clark, BC, Ploutz-Snyder, LL, and Kanaley, JA. Growth hormone and muscle function responses to skeletal muscle ischemia. J Appl Physiol 101: 1588-1595, 2006.
137. Pincivero, DM, Lephart, SM, and Karunakara, RG. Effects of rest interval on isokinetic strength and functional performance after short-term high intensity training. Br J Sport Med 31: 229-234, 1997.
138. Pipes, TV. Strength training and fiber types. Sch Coach 63: 67-70, 1994.
139. Prado, LG, Makarenko, I, Andresen, C, Krüger, M, Opitz, CA, Linke, WA. Isoform diversity of giant proteins in relation to passive and active contractile properties of rabbit skeletal muscles. J Gen Physiol 126: 461-480, 2005.
140. Raastad, T, Glomsheller, T, Bjøro, T, and Hallén, J. Changes in human skeletal muscle contractility and hormone status during 2 weeks of heavy strength training. Eur J Appl Physiol 84: 54-63, 2001.
141. Ratamess, NA, Falvo, MJ, Mangine, GT, Hoffman, JR, Faigenbaum, AD, and Kang, J. The effect of rest interval length on metabolic responses to the bench press exercise. Eur J Appl Physiol 100: 1-17, 2007.
142. Reaburn, P, Logan, P, and MacKinnon, L. Serum testosterone response to high-intensity resistance training in male veteran sprint runners. J Strength Cond Res 11: S256-S260, 1997.
143. Rennie, MJ. Claims for the anabolic effects of growth hormone: A case of the emperor's new clothes? Br J Sport Med 37: 100-105, 2003.
144. Robergs, RA, Ghiasvand, F, and Parker, D. Biochemistry of exercise induced metabolic acidosis. Am J Physiol. Reg Int Comp Physiol 287: R502-R516, 2003.
145. Rooney, KJ, Herbert, RD, and Balnave, RJF. Fatigue contributes to the strength training stimulus. Med Sci Sport Exerc 26: 1160-1164, 1994.
146. Rosenblatt, JD, Yong, D, and Parry, DJ. Satellite cell activity is required for hypertrophy of overloaded adult rat muscle. Mus Nerve 17: 608-613, 1994.
147. Roux, PP and Blenis, J. ERK and p38 MAPK-activated protein kinases: A family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev 68: 320-344, 2004.
148. Sabourin, LA and Rudnicki, MA. The molecular regulation of myogenesis. Clin Gen 57: 16-25, 2000.
149. Schott, J, McCully, K, and Rutherford, OM. The role of metabolites in strength training. II. Short versus long isometric contractions. Eur J Appl Physiol 71: 337-341, 1995.
150. Schwab, R, Johnson, GO, Housh, TJ, Kinder, JE, and Weir, JP. Acute effects of different intensities of weight lifting on serum testosterone. Med Sci Sport Exerc 25: 1381-1385, 1993.
151. Segal, RL, Wolf, SL, DeCamp, MJ, Chopp, MT, and English, AW. Anatomical partitioning of three multiarticular human muscles. Acta Anat 142: 261-266, 1991.
152. Shepstone, TN, Tang, JE, Dallaire, S, Schuenke, MD, Staron, RS, and Phillips, SM. Short-term high- vs. low-velocity isokinetic lengthening training results in greater hypertrophy of the elbow flexors in young men. J Appl Physiol 98: 1768-1776, 2005.
153. Shinohara, M, Kouzaki, M, Yoshihisa T, and Fukunaga T. Efficacy of tourniquet ischemia for strength training with low resistance. Eur J Appl Physiol 77: 189-191, 1998.
154. Siff, MC and Verkhoshansky, YV. Supertraining (4th ed.). Denver, CO: Supertraining International, 1999.
155. Sinha-Hikim, I, Cornford, M, Gaytan, H, Lee, ML, and Bhasin, S. Effects of testosterone supplementation on skeletal muscle fiber hypertrophy and satellite cells in community-dwelling older men. J Clin Endocrinol Metab 91: 3024-3033, 2006.
156. Sjøgaard, G. Water and electrolyte fluxes during exercise and their relation to muscle fatigue. Acta Physiol Scan Suppl 556: 129-136, 1986.
157. Sjøgaard, G, Adams, RP, and Saltin, B. Water and ion shifts in skeletal muscle of humans with intense dynamic knee extension. Am J Physiol 248: R190-R196, 1985.
158. Smilios, I, Pilianidis, T, Karamouzis, M, and Tokmakidis, SP. Hormonal responses after various resistance exercise protocols. Med Sci Sport Exerc 35: 644-654, 2003.
159. Smith, LL. Cytokine hypothesis of overtraining: A physiological adaptation to excessive stress? Med Sci Sport Exerc 32: 317-331, 2000.
160. Smith, LL. Tissue trauma: The underlying cause of overtraining syndrome? J Strength Cond Res 18: 185-193, 2004.
161. Smith, RC and Rutherford, OM. The role of metabolites in strength training. I. A comparison of eccentric and concentric contractions. Eur J Appl Physiol Occup Physiol 71: 332-336, 1995.
162. Spangenburg, EE. Changes in muscle mass with mechanical load: Possible cellular mechanisms. Appl Physiol Nutr Metab 34: 328-335, 2009.
163. Staron, RS, Karapondo DL, Kraemer WJ, Fry AC, Gordon SE, Falkel JE, Hagerman FC, and Hikida, RS. Skeletal muscle adaptations during early phase of heavy-resistance training in men and women. J Appl Physiol 76: 1247-1255, 1994.
164. Sternlicht, E, Rugg, S, Fujii, LL, Tomomitsu, KF, and Seki, MM. Electromyographic comparison of a stability ball crunch with a traditional crunch. J Strength Cond Res 21: 506-509.
165. Stoll, B. Liver cell volume and protein synthesis. Biochem J 287: 217-222, 1992.
166. Stone, MH, O'Bryant, HS, and Garhammer, JG. A hypothetical model for strength training. J Sport Med Phys Fitness 21: 342-351, 1981.
167. Stoppani, J. Encyclopedia of Muscle and Strength. Champaign, IL: Human Kinetics Publishers, 2006. pp. 151.
168. Stull, GA and Clarke, DH. Patterns of recovery following isometric and isotonic strength decrement. Med Sci Sports 3: 135-139, 1971.
169. Suga, T, Okita, K, Morita, N, Yokota, T, Hirabayashi, K, Horiuchi, M, Takada, S, Takahashi, T, Omokawa, M, Kinugawa, S, and Tsutsui, H. Intramuscular metabolism during low-intensity resistance exercise with blood flow restriction. J Appl Physiol 106: 1119-1124, 2009.
170. Suzuki, YJ and Ford, GD. Redox regulation of signal transduction in cardiac and smooth muscle. J Mol and Cell Cardiol 31: 345-353, 1999.
171. Takarada, Y, Nakamura, Y, Aruga, S, Onda, T, Miyazaki, S, and Ishii, N. Rapid increase in plasma growth hormone after low-intensity resistance exercise with vascular occlusion. J Appl Physiol 88: 61-65, 2000.
172. Takarada, Y, Takazawa, H, and Ishii, N. Applications of vascular occlusion diminish disuse atrophy of knee extensor muscles. Med Sci Sport Exerc 32: 2035-2039, 2000.
173. Takarada, Y, Takazawa, H, Sato, Y, Takebayashi, S, Tanaka, Y, and Ishii, N. Effects of resistance exercise combined with moderate vascular occlusion on muscular function in humans. J Appl Physiol 88: 2097-2106, 2000.
174. Tanimoto, M, Sanada, K, Yamamoto, K, Kawano, H, Gando, Y, Tabata, I, Ishii, N, and Miyachi, M. Effects of whole-body low-intensity resistance training with slow movement and tonic force generation on muscular size and strength in young men. J Strength Cond Res 22: 1926-1938, 2008.
175. ter Haar Romeny, BM, Denier van der Gon, JJ, and Gielen, CCAM. Changes in recruitment order of motor units in the human biceps muscle, Exp Neurol 78: 360-368, 1982.
176. ter Haar Romeny, BM, Denier van der Gon, JJ, and Gielen, CCAM. Relation between location of a motor unit in the human biceps brachii and its critical firing levels for different, tasks. Exp Neurol 85: 631-650, 1984.
177. Tesch, PA. Skeletal muscle adaptations consequent to long-term heavy resistance exercise. Med Sci Sport Exerc 20(5 Suppl.): S132-S134, 1988.
178. Tesch, PA, Colliander, EB, and Kaiser, P. Muscle metabolism during intense, heavy-resistance exercise. Eur J Appl Physiol Occup Physiol 55: 362-366, 1986.
179. Tesch, PA and Larsson, L. Muscle hypertrophy in bodybuilders. Eur J Appl Physiol Occup Physiol 49: 301-306, 1982.
180. Tesch, PA, Ploutz-Snyder, LL, Ystrom, L, Castro, MJ, and Dudley, GA. Skeletal muscle glycogen loss evoked by resistance exercise. J Strength Cond Res 12: 67-73, 1998.
181. Thomas, G and Hall, MN. TOR signalling and control of cell growth. Curr Opin Cell Biol 9: 782-787, 1997.
182. Toigo, M and Boutellier, U. New fundamental resistance exercise determinants of molecular and cellular muscle adaptations. Eur J Appl Physiol 97: 643-663, 2006.











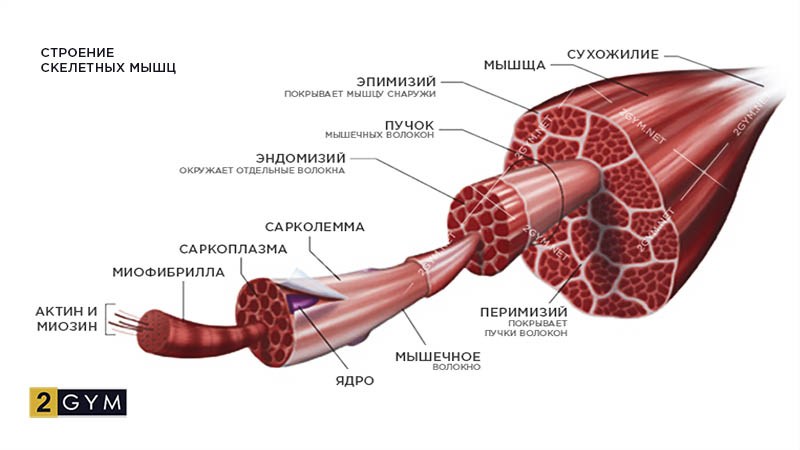












Войти через ( Регистрация )
или оставьте комментарий как гость
Оставьте первый комментарий!