Умеренные когнитивные нарушения
Мишенью для исследований являются недементные когнитивные нарушения, которые, с одной стороны, представляют собой достаточно четкий клинический синдром, с другой – диагностируются относительно редко, особенно в качестве начальных этапов уже активно идущего заболевания.
Для характеристики когнитивных расстройств, не достигающих стадии деменции, применима концепция умеренных когнитивных нарушений (УКН), которая была разработана первоначально для выявления пациентов на ранних стадиях болезни Альцгеймера (БА) [4, 36].
В настоящее время для диагностики синдрома умеренных когнитивных нарушений используются критерии, которые предусматривают наличие жалоб на повышенную забывчивость или снижение умственной работоспособности в сравнении с имевшимися ранее возможностями пациента, подтвержденные нейропсихологическим тестированием, способные приводить к легкому ухудшению в сложных видах деятельности, но не соответствующие критериям деменции.
Применение этих критериев позволяет диагностировать синдром умеренных когнитивных нарушений, но не заболевание, ведущее к его формированию.
Активное изучение и внедрение в клиническую практику новых лабораторных и нейровизуализационных биомаркеров позволило вплотную приблизиться к диагностике болезни Альцгеймера именно на этапе умеренных когнитивных нарушений.
К этим биомаркерам относятся концентрация β-амилоида, тау-протеина и фосфорилированного тау-протеина в цереброспинальной жидкости (ЦСЖ), позитронно-эмиссионная томография (ПЭТ) с фтор18-дезоксиглюкозой (ФДГ) и лигандами амилоида (так называемое питтсбургскоевещество – PIB), волюметрическая магнитно-резонансная томография (МРТ) [2, 9].
В настоящее время группой экспертов Американского национального института старения (National Institute on Aging – NIA) и альцгеймеровской ассоциации предложены для обсуждения новые критерии диагностики болезни Альцгеймера с позиции патофизиологического подхода, основанного на раннем выявлении положительных биомаркеров, что позволяет диагностировать заболевание на додементной стадии [3].
Возможности ранней диагностики открывают перспективы для начала ранней профилактики прогрессирования заболевания, лежащего в основе развития синдрома умеренных когнитивных нарушений, однако на настоящий момент общепринятые рекомендации, особенно в отношении выбора метода медикаментозной коррекции, по сути отсутствуют.
Профилактика когнитивных нарушений
Наиболее оправданным с позиции доказательной медицины является проведение профилактических мероприятий, которые включают как направления доклинической профилактики, так и учет, и коррекцию возможных факторов риска развития когнитивных нарушений.
Доклиническая профилактика подразумевает ведение здорового образа жизни, который включает отказ от курения, избыточного приема алкоголя, борьбу с избыточной массой тела, а также активную интеллектуальную и физическую деятельность, правильное питание с обязательным включением в рацион продуктов с высоким содержанием полиненасыщенных жирных кислот.
Проведенный метаанализ показал положительное влияние регулярных физических упражнений на общее функциональное состояние пациентов [23]. Особенно значимое снижение риска развития когнитивных нарушений (на 70–75%) наблюдается в отношении сосудистой деменции [38].
В многочисленных исследованиях показано, что активная когнитивная деятельность, когнитивный тренинг приводят к улучшению памяти, речевой активности и в конечном итоге снижают риск развития болезни Альцгеймера [26].
Данный эффект сохраняется по крайней мере в течение 2 лет, некоторые исследователи приводят результаты 5-летнего периода наблюдения [45].
Включение в рацион морепродуктов, растительных продуктов оказывает положительное влияние на состояние когнитивных функций.
Диета, включающая морепродукты, фрукты и овощи, обеспечивает поступление омега-3 жирных кислот, антиоксидантов (витамин Е и флавоноиды) и витаминов группы В [11].
Более того, показано, что наибольший эффект связан с ежедневным употреблением в пищу не менее 75 г рыбы [34]. Регулярное употребление фруктов и овощей, даже в виде соков, также связано со снижением риска развития болезни Альцгеймера, по некоторым данным, на 28% [8, 30].
В отношении витаминной поддержки у пациентов с умеренными когнитивными нарушениями данные противоречивы. По результатам метаанализа исследований не показано влияния длительного приема витамина В12, В6, фолиевой кислоты на состояние когнитивных функций [7].
Первичная профилактика предусматривает выявление и контроль факторов риска с целью предотвращения развития и прогрессирования когнитивных нарушений.
Наиболее хорошую доказательную базу имеют мероприятия, направленные на коррекцию артериальной гипертензии, сахарного диабета, мерцательной аритмии, патологии сердца [10, 19, 22].
Статины и умеренные когнитивные нарушения
Данные исследований в отношении эффективности использования статинов противоречивы. В некоторых работах показан положительный эффект в виде снижения риска развития умеренных когнитивных нарушений и болезни Альцгеймера до 50% [12, 40].
Однако в более масштабных исследованиях, таких как Heart Pro-tection Study и PROSPER, в которых соответственно исследовались симвастатин и правастатин, не получено доказательств их превентивного эффекта [14, 39].
Нестероидные противовоспалительные препараты
Из клинической наблюдательной практики были получены сведения о том, что регулярный прием нестероидных противовоспалительных препаратов у больных ревматоидным артритом и заместительной гормональной терапии у женщин приводил к снижению заболеваемости БА.
Однако исследования эффективности и безопасности длительного приема напроксена, целекоксиба, комбинации эстрогенов и прогестерона не подтвердили эти данные, и сегодня нет рекомендаций по использованию данных направлений терапии в лечении пациентов с умеренными когнитивными нарушениями [24, 32].
Ноотропы
Исторически в странах постсоветского пространства наиболее широко в лечении когнитивных нарушений применяются вазоактивные и ноотропные препараты, в отношении которых имеются отдельные сведения о положительном влиянии на разные сферы когнитивной деятельности [46], однако убедительная доказательная база, особенно в отношении лечения пациентов с умеренных когнитивных нарушений, отсутствует.
Подобная же ситуация наблюдается в отношении возможностей применения нейротрофических и нейропротективных средств [20]. В 3-летнем проспективном исследовании показано модифицирующее влияние на прогрессирование когнитивных нарушений при применении повторных курсов больших доз церебролизина [1].
Отдельно следует остановиться на возможностях применения средств, хорошо себя зарекомендовавших при лечении пациентов с деменцией разного генеза. Логично предположить, что назначение этих средств на более ранних этапах заболевания также должно давать отчетливый эффект, однако результаты проведенных исследований оказались хуже ожидаемых.
Эффективность донепезила и витамина Е в лечении пациентов с умеренными когнитивными нарушениями изучалась в 3-летнем исследовании, в которое были включены 769 пациентов в возрасте 55–90 лет, которые были рандомизированы в группы, получавшие витамин Е (2000 МЕ в день), донепезил (10 мг в день) или плацебо.
Обнаружено, что значимое снижение риска развития болезни Альцгеймера в сравнении с плацебо отмечено только в течение 1 года от начала терапии донепезилом (соответственно 6 и 15%), но через 3 года частота конверсии между группами не отличалась (25 и 28%) [37].
Также не было получено статистических различий по частоте конверсии умеренных когнитивных нарушений в болезни Альцгеймера при назначении галантамина.
В исследованиях Gal-Int-18 и Gal-Int-11 развитие болезни Альцгеймера в сравнении с группой плацебо наблюдалось соответственно в 17 и 21 и в 13 и 18% случаев. Однако были получены данные, свидетельствующие о снижении скорости прогрессирования атрофических изменений коры головного мозга [15].
В исследовании InDDEx изучались эффективность и безопасность применения ривастигмина в лечении пациентов с умеренными когнитивными нарушениями. Среди пациентов, получавших ривастигмин, через 48 месяцев диагностирована болезнь Альцгеймера у 17,3%, в группе плацебо – у 21,4% [21].
Таким образом, сегодня нет общепринятых рекомендаций назначать ингибиторы ацетилхолинэстеразы (АХЭ) на этапе умеренных когнитивных нарушений. Между тем, некоторые специалисты не столь однозначно относятся к отказу от применения ингибиторов АХЭ на стадии умеренных когнитивных нарушений, особенно амнестического типа.
Метаанализ исследований по применению ингибиторов АХЭ, включавший 3,574 пациента, показал, что в группе получавших какой-либо ингибитор АХЭ конверсия в БА произошла у 15,4%, а в группе плацебо – у 20,4% [17].
В США в специализированных центрах был проведен опрос врачей и выяснилось, что 25% пациентов с умеренными когнитивными нарушениями принимают антидементные препараты (ингибиторы АХЭ иакатинол), 50% – статины, 20% – антиоксиданты (витамин Е, аскорбиновая кислота), 6,4% – витамины (фолиевая кислота) [43].
По-видимому, добиться повышения эффективности ингибиторов АХЭ можно за счет более дифференцированного их назначения.
В качестве предикторов назначения в первую очередь можно рассматривать наличие патофизиологических признаков нейродегенеративного процесса: отложение амилоида в паренхиме мозга по данным ПЭТ с лигандами амилоида, снижение концентрации b-амилоида и повышение концентрации тау-белка и фосфорилированного тау-белка в ликворе.
При отсутствии возможности получить такие данные можно ориентироваться на следующие признаки: низкий начальный балл по шкале MMSE; рано выявляемые нарушения семантической памяти и речи; прогрессирующее течение; отягощенный семейный анамнез; наличие патологических изоформ гена АПОЕ; признаки атрофии гиппокампа по данным МРТ; нарушения перфузии и метаболизма по данным однофотонной эмиссионной томографии и ПЭТ в височно-теменных отделах головного мозга.
Эти же принципы могут лежать в основе методологии изучения эффективности и безопасности средств, обладающих способностью менять течение заболевания, и в первую очередь течение БА.
Основные стратегии, модифицирующие течение болезни Альцгеймера, направлены на разные звенья патологического процессинга амилоида. Препараты лития стимулируют нейропластичность, ингибируют формирование β-амилоида и гиперфосфорилирование тау-белка и за счет этого могут уменьшать риск развития деменции [31].
В клинических исследованиях получены как положительные [27], так и отрицательные результаты [18]. Препарат PBT2 является металлпротеазой, которая уменьшает медь- и цинк-опосредованную токсическую олигомеризацию β-амилоида.
Результаты, полученные в пилотных исследованиях, показали незначительный клинический эффект[28]. Эффект ингибитора фактора некроза опухолей α (Etanercept) показан в небольших пилотных исследованиях и требует дальнейшего изучения [25].
Tarenflurbil
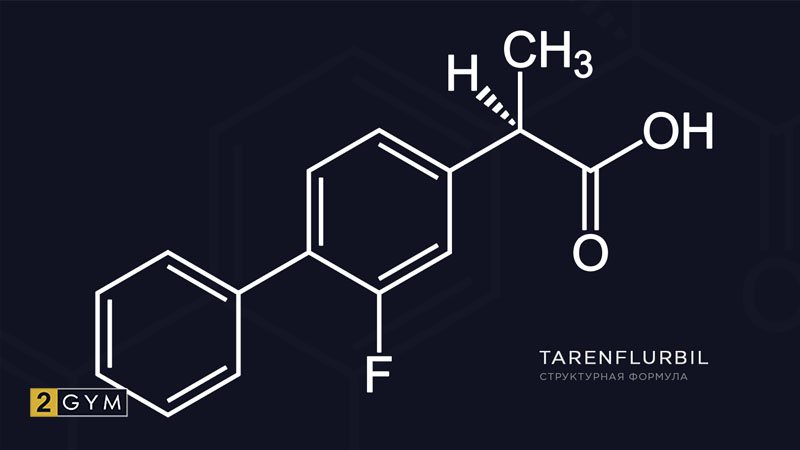
Исследование эффективности препарата Tarenflurbil, который селективно влияет на продукцию β-амилоида-42, проведенное в группе пациентов с болезнью Альцгеймера, показало снижение прогрессирования нарушений повседневной деятельности и лучшую сохранность общего функционального состояния [44].
Компания, занимающаяся разработкой и исследованиями препарата под торговым названием Flurizan, объявила о прекращении работы над данным проектом, так как Myrial Genetics пришла к выводу, что Tarenflurbil не улучшал когнитивные способности пациентов.
Однако необходимо проведение дополнительных широкомасштабных исследований, чтобы определить целесообразность применения данных препаратов на этапе умеренных когнитивных нарушений.
На разных стадиях клинических исследований находятся методы активной и особенно пассивной иммунизации.
Наиболее перспективными являются методы иммунизации с помощью моноклональных антител к амилоиду (соланезумаб, бапинезумаб, гантенерумаб).
Использование моноклональных антител на этапе легкой и умеренной деменции не показало своей эффективности, и в настоящее время большие надежды связываются с ранним началом терапии на этапе умеренных когнитивных нарушений [35].
Таким образом, на сегодняшний день нет убедительных доказательств возможности разных лекарственных средств влиять на течение нейродегенеративного процесса.
Возможно, это обусловлено тем, что патогенез развития когнитивных нарушений как нейродегенеративной, так и сосудистой этиологии включает сразу несколько факторов, каждый из которых по-своему важен на разных этапах заболевания.
В связи с этим перспективным представляется более дифференцированное применение средств патогенетического и симптоматического характера в зависимости от стадии заболевания.
Гинкго билоба при лечении когнитивных нарушений
Альтернативный путь – комбинирование средств или использование препаратов с мультимодальным воздействием на разные звенья патогенеза. В связи с этим не ослабевает интерес к изучению перспектив применения лекарственных средств, изготовленных на основе экстракта листьев гинкго билоба (ginkgo biloba).
Механизм действия этих препаратов основан на полимодальном эффекте, включающем в основном реопозитивный, антиоксидантный и нейропротективный компоненты.
Препарат улучшает мозговое кровообращение и снабжение мозга кислородом и глюкозой, нормализует обмен веществ в клетках, реологические свойства крови и микроциркуляцию, оказывает противоотечный эффект, нормализует нейромедиаторные процессы в головном мозге.
Нейропротективные свойства гинкго билоба обусловлены способностью входящих в его состав флавоноидных гликозидов блокировать свободные радикалы, которые вызывают окислительный стресс и способствуют прогрессированию нейродегенеративных заболеваний.
Флавоноидные гликозиды также стимулируют высвобождение эндотелиальных факторов, регулируют ионный баланс и ингибируют ферменты фосфодиэстеразу и фосфолипазу, что приводит к снижению тонуса артериол и улучшению микроциркуляции.
Кроме того, вазорегулирующий эффект проявляется повышением тонуса вен [5]. Также в последние годы получены доказательства возможности экстракта гинкго билоба влиять на процессы патологического амилоидогенеза – одного их основных механизмов развития деменции альцгеймеровского типа [13].
В ряде клинических исследований показана эффективность экстракта листьев гинкго билоба при деменции альцгеймеровского типа и сосудистой деменции [29, 33, 42].

Экстракт Гинкго Билоба от различных производителей представлен в интернет-магазине iHerb. Наиболее авторитетными торговыми марками являются Doctor's Best (Extra Strength Ginkgo), Nature's Bounty (Ginkgo Biloba), Mason Natural (Whole Herb Ginkgo Biloba), Nature's Answer (Ginkgo), Now Foods (Ginkgo Biloba, Double Strength).
Ссылка на пищевые добавки с экстрактом Гинкго Билоба
Для того, чтобы получить дополнительную скидку в iHerb, используйте промокод AKL7443 на этапе оформления заказа.
Эффективность стандартизированного экстракта гинкго билоба в лечении пациентов с умеренными когнитивными нарушеничми, подтверждена результатами многоцентрового исследования, проведенного в России [6].
В то же время результаты длительных 5-летних исследований GEM и GuidAge, направленных на изучение возможности экстракта гинкго билоба оказывать превентивный эффект на развитие БА и других видов деменции, оказались хуже ожидаемых, не продемонстрировав убедительных различий с группой плацебо [16, 41].
Возможно, такой результат обусловлен тем, что в исследования включались достаточно гетерогенные по клиническим проявлениям пациенты, не была проведена дифференциация синдрома УКН.
В связи с этим перспективным представляется выделение более однородных групп пациентов, и дальнейшего изучения требует применение экстракта гинкго билоба у больных с цереброваскулярной патологией с целью профилактики развития и прогрессирования сосудистых когнитивных нарушений.































Войти через ( Регистрация )
или оставьте комментарий как гость
Оставьте первый комментарий!